癌症是导致全球人类死亡的主要原因之一。近年来,我国癌症患者的发病率和死亡率也一直在上升,已成为严重的公共卫生问题。化疗药物是治疗肿瘤的有效手段之一,然而提高药物治疗效率仍然是一个关键挑战,而细胞内吞作为摄取和递送药物的关键步骤。内吞是指细胞摄取外部物质的生物学过程,细胞膜将外部颗粒或液滴包裹成囊泡并递送到相应的细胞器。内吞可分为不同类型,包括网格蛋白介导的内吞、小窝蛋白介导的内吞、快速内吞作用、糖基磷脂酰肌醇锚定蛋白富集的早期内吞作用、吞噬作用和巨胞饮等六种主要内吞途径。不同内吞途径的货物摄取、分选和靶向递送受到多种信号通路、细胞骨架和分子马达等蛋白复合物的精确调控。这些过程既相对独立又相互影响,围绕细胞内吞的调控仍有很多未解之谜。
近日,金沙集团1862cc蒋思远副教授和生命科学技术学院高山教授研究团队合作在Science Bulletin发表了题为《HUNK Inhibits Cargo Uptake and Lysosomal Traffic in the Caveolar Pathway via the AGAP3/ARF6》的研究论文,对激素上调的Neu相关激酶HUNK在内吞过程中的调控机制进行了深入研究。这项研究可能为今后癌症和其他相关疾病的治疗提供新的途径。
激素相关激酶(HUNK)是一种丝氨酸/苏氨酸蛋白激酶,在肿瘤发生中发挥着多种角色。为了探索HUNK在癌中的分子功能,研究人员通过对敲除HUNK细胞的转录组进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes)分析,发现HUNK可以影响细胞内吞和内体运输。通过对不同内吞途径的深入研究,研究人员发现,HUNK敲除细胞会促进物质(如牛血清白蛋白)的摄取,而且主要选择性地抑制小窝蛋白介导的内吞,并且依赖其激酶活性。小窝是细胞膜上50-100纳米的洞穴样凹陷,对细胞吸收和运输某些毒素、细菌、病毒、生长因子和某些循环蛋白非常重要。同时,HUNK敲除细胞系中,内体标记物(Rab5、和Rab7)和溶酶体标记物(LAMP1)的共定位表明敲除细胞中的早期内体/晚期内体/溶酶体递送途径增强,早期内体向晚期内体转化加快,内吞溶酶体的形成增加。通过超分辨显微镜和纳米颗粒检测技术等手段检测发现HUNK敲除细胞中的溶酶体更大、更多,进一步表明了HUNK敲除对内吞溶酶体的形成具有促进作用。活细胞荧光影像也揭示了敲除细胞系中内体的运输和融合的加快。分子机制的研究中,通过蛋白互作和体外磷酸化技术发现HUNK磷酸化AGAP3的丝氨酸396位点(S396)。AGAP3的磷酸化促进了其在早期内体中的定位,进而导致ARF6的GTP水解,从而减少早期向晚期内吞体的转化,并最终降低了内吞溶酶体的大小和数量。以白蛋白为货物模型,在HUNK敲除细胞系中研究发现小窝更快地内吞白蛋白,并实现了更好的溶酶体定位和降解。同时,HUNK敲减的结直肠癌细胞更高效地内吞化疗药物白蛋白紫杉醇,进而实现了更好的肿瘤杀伤,HUNK抑制剂和白蛋白紫杉醇的联合也展现出更好的治疗效果。
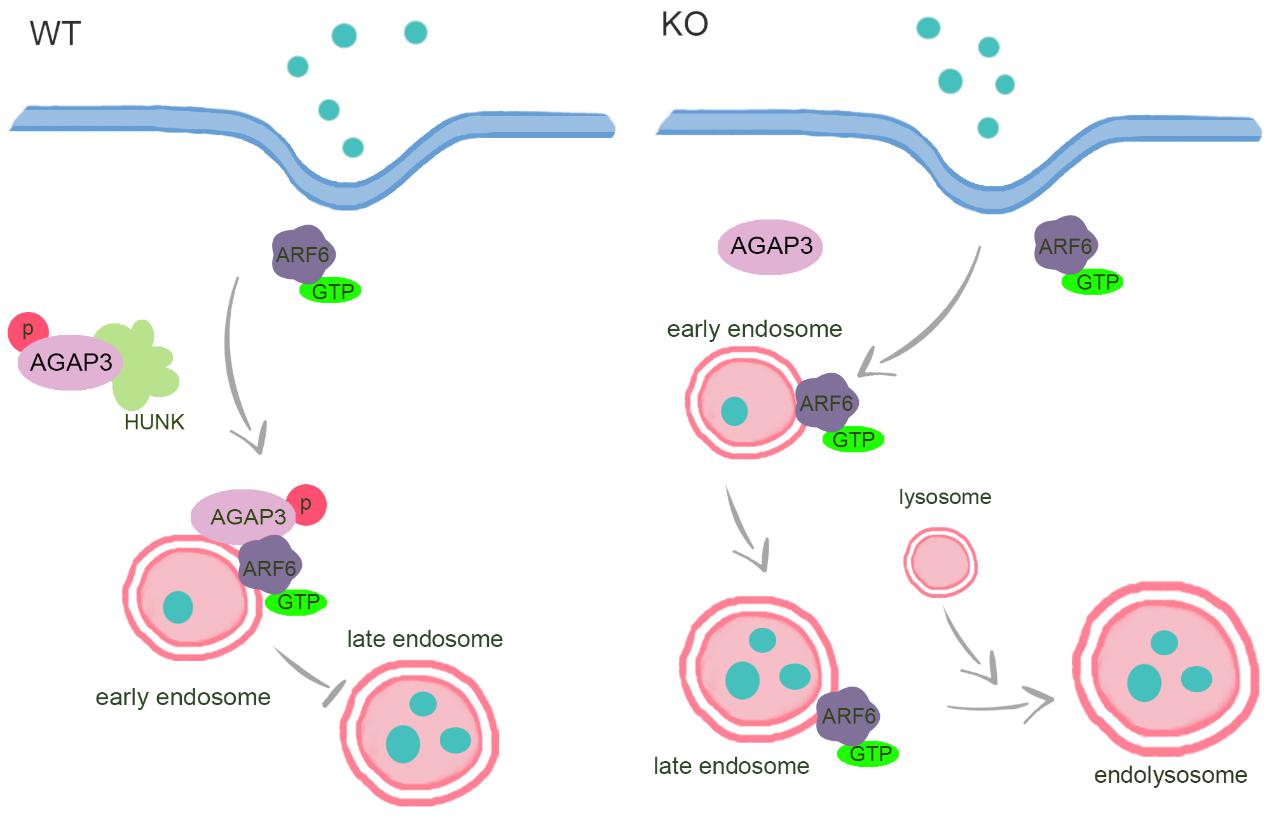
HUNK在结直肠癌细胞中调控小窝内吞及货物运输的模式图
在前期研究中,高山教授团队在已两篇关键性的论文中阐述了HUNK激酶在结直肠癌转移中的作用。首先,在Cell Death & Disease杂志上的一篇研究《HUNK inhibits epithelial-mesenchymal transition of CRC via direct phosphorylation of GEF-H1 and activating RhoA/LIMK-1/CFL-1》中,该团队发现HUNK激酶通过磷酸化GEF-H1,进而激活RhoA/LIMK-1/CFL-1通路,从而抑制上皮间质转化。接着,在BBRC期刊上发表的另一篇研究《Hypoxia inhibits HUNK kinase activity to induce epithelial-mesenchymal transition》中,研究团队进一步找到了HUNK的激酶活性调控因素。这项研究揭示了HUNK在细胞缺氧环境下改变激酶活性,参与上皮间质转化的调控。这两项研究揭示了HUNK作为细胞缺氧环境和肿瘤转移的重要调控因素。
在两项前期研究基础上,本研究进一步揭示了HUNK激酶在特异性调控小窝内吞和货物从内吞到溶酶体递送的新通路和分子机制,扩展了我们对内吞和内体靶向运输的认知。这为通过小窝内吞的药物治疗癌症提供了新的理论基础,进而推动药物靶向技术的研究和应用,为攻克癌症等疾病提供了新的思路和方向。综合而言,研究团队揭示了HUNK在结直肠癌中的多功能作用,为癌症发送发展和治疗提供了新的靶点和理论依据。
本论文第一作者为金沙集团1862cc蒋思远副教授,通讯作者为金沙集团1862cc生命科学学院高山教授。该研究得到了国家自然科学基金和国家重点研发计划的支持。

 搜索
搜索