近日,金沙集团1862cc肾脏病研究所刘必成教授、王彬副主任医师团队在《Cell》子刊《Molecular Therapy》(IF:11.454)在线发表了题为“Tubular-specific CDK12 knockout causes a defect in urine concentration due to premature cleavage of the slc12a1 gene”的论著。

随着人口老龄化,肿瘤发病率逐年增加。近年来,CDK12抑制剂Dinaciclib作为新型抗肿瘤药物,在前列腺癌和膀胱癌等治疗中显示了显著的抗肿瘤效果,但与此同时,临床研究发现有高达18%-66.7 %的多尿、水电解质紊乱和肾功能受损,相关机制未见研究报道。
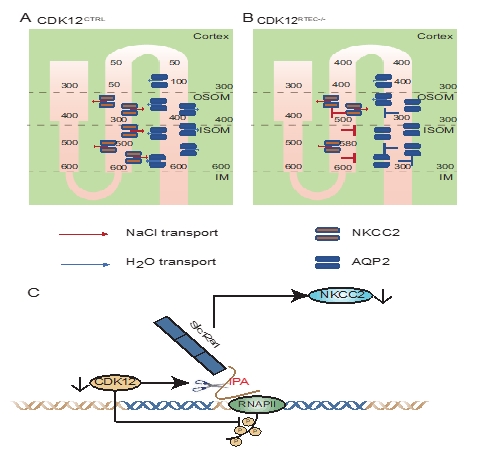
金沙集团1862cc肾脏病研究所刘必成教授团队在国际上首次构建了CDK12肾小管特异性敲除小鼠,发现该小鼠有自发性多饮多尿、低渗尿以及肾盂扩张等临床表型。课题组通过转录组测序和后续功能验证实验发现,CDK12肾小管特异性敲除小鼠的多尿与其肾小管髓袢升支粗段钠钾二氯共转运体(NKCC2)的表达下调有关。NKCC2是临床上普遍使用的利尿剂呋塞米的分子靶点,抑制或下调NKCC2的表达可以通过减少原尿中NaCl的重吸收,降低肾间质高渗梯度,最终导致尿液浓缩异常。该课题组进一步通过全长转录组测序技术发现,CDK12肾小管特异性敲除小鼠肾组织中NKCC2的编码基因Slc12a1的转录特征发生了明显变化,出现了更多短的Slc12a1转录本,这可能与CDK12抑制后导致Slc12a1基因内含子聚腺苷酸化事件发生增加有关。
该研究通过建立肾小管CKD12敲除模型,首次揭示了CDK12在维持肾脏水盐平衡中的分子作用机制,解释了新型抗肿瘤药CKD12抑制剂导致水盐代谢紊乱和肾损伤的可能机制,为将来临床预防和治疗该类药物的副作用
本文第一作者为王彬副主任医师和博士生王垚,刘必成教授、闻毅研究员为通讯作者。提供了新的干预靶点。
参考文献:
Wang et al., Tubular-specific CDK12 knockout causes a defect in urine concentration due to premature cleavage of the
slc12a1 gene, Molecular Therapy (2022), https://doi.org/10.1016/j.ymthe.2022.05.012

 搜索
搜索